Antwort Co to je degenerovaný Orbital? Weitere Antworten – Co je to Vakantní orbital
Existencí tzv. vakantních orbitalů (→ orbitalů, jenž neobsahují elektrony, mají však stejné n jako zaplňené orbitaly) a dodáním energie lze vaznost zvětšit tím, že elektron vystoupí na vyšší energetickou hladinu (! stejné n, vyšší l). To dovoluje atomu poskytnout více nepárových elektronů a tím i větší vaznost.Orbital atomový
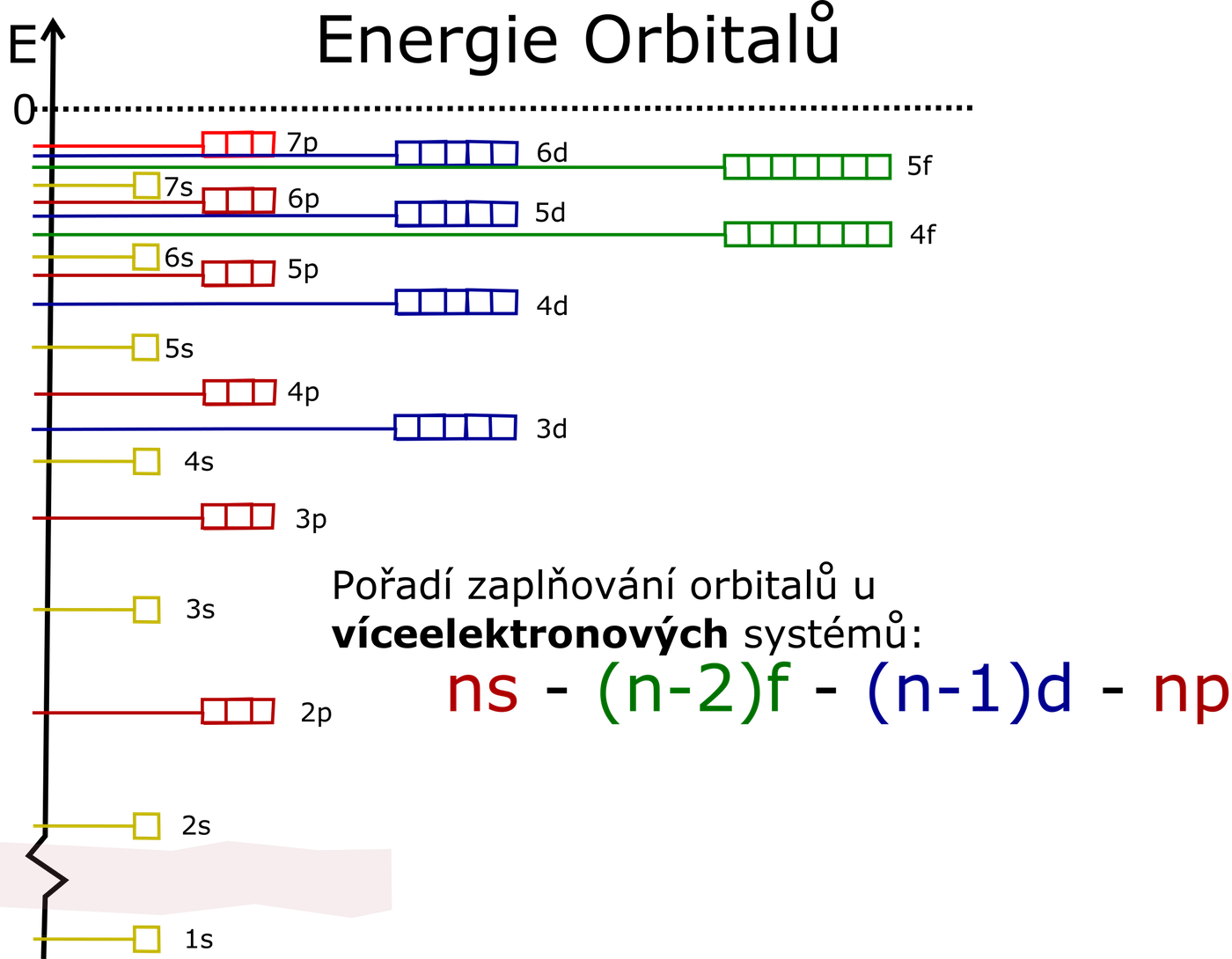
vymezují jakousi existenční oblast elektronu v atomu. Této oblasti nejpravděpodobnějšího výskytu elektronu se říká atomový orbital. Atomové orbitaly se označují symbolem obsahujícím hlavní kvantové číslo n a písmeno, které odpovídá hodnotě vedlejšího kvantového čísla l.Orbitaly se tedy zaplňují v pořadí: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s … Z uvedených poznatků je možné zapsat elektronovou konfiguraci libovolného chemického prvku či iontu.
Co je to Výstavbový princip : Výstavbový princip (tzv. Aufbau princip) říká, že orbitaly s nižší energií se zaplňují elektrony dříve než orbitaly s energií vyšší. V základním stavu atomu tedy elektrony obsazují jednotlivé slupky a podslupky tak, aby měly co nejnižší energii.
Co znamená excitovaný stav
Excitovaný stav je jakýkoliv stav fyzikálního systému, jehož energie je větší než nejnižší možná, tedy větší než energie základního stavu. Termín se používá především v kvantové fyzice nebo fyzikální chemii pro systémy (atom, molekula, atomové jádro), které mají stavy s určitými diskrétními hladinami energie.
Co je to excitovaný : Excitace (neboli vybuzení) je fyzikální proces, při kterém dochází k přechodu základního energetického stavu atomu, molekuly či iontu do stavu s vyšší energetickou hladinou. Excitovaná částice se pak nachází v excitovaném stavu.
se značí n, vyjadřuje energii elektronu. Nabývá hodnot 1 až 7. Orbitaly, které mají stejné hlavní kvantové číslo, tvoří jednu elektronovou vrstvu. Atomy dosud známých prvků obsazují elektrony 7 elektronových vrstev, které se označují čísly 1 až 7 nebo písmeny K,L,M,N,O,P,Q.
Atom může mít 1 – 7 elektronových vrstev. Počet elektronů v jednotlivých vrstvách atomu je přesně stanoven. Rozmístění elektronů v elektronovém obalu (elektronová konfigurace atomu) určuje chemické vlastnosti prvků.
Kolik je vrstev v atomu
Atomy dosud známých prvků obsazují elektrony 7 elektronových vrstev, které se označují čísly 1 až 7 nebo písmeny K,L,M,N,O,P,Q. Maximální počet elektronů v každé vrstvě se rovná dvojnásobku počtu orbitalů, protože v jednom orbitalu mohou být maximálně dva elektrony.Excitovaný stav je jakýkoliv stav fyzikálního systému, jehož energie je větší než nejnižší možná, tedy větší než energie základního stavu. Termín se používá především v kvantové fyzice nebo fyzikální chemii pro systémy (atom, molekula, atomové jádro), které mají stavy s určitými diskrétními hladinami energie.Excitovaný stav je jakýkoliv stav fyzikálního systému, jehož energie je větší než nejnižší možná, tedy větší než energie základního stavu. Termín se používá především v kvantové fyzice nebo fyzikální chemii pro systémy (atom, molekula, atomové jádro), které mají stavy s určitými diskrétními hladinami energie.
Nejvzdálenější vrstva v atomovém obalu obsazená elektrony se nazývá valenční. Pro konkrétní atom se číslo jeho valenční vrstvy shoduje s číslem periody (řádku), ve které se daný chemický prvek v periodické soustavě nachází.
Které prvky nelze Excitovat : Helium, neon a argon teoreticky nelze excitovat (nemají vakantní orbitaly). Prvky 18. skupiny tak tvoří jen málo molekul (první molekuly obsahující p6 prvek byly připraveny r. 1962, byly to sloučeniny xenonu a kyslíku a xenonu a fluoru).
Co je to Hundovo pravidlo : Hundovo pravidlo (Pravidlo maximálního spinu)
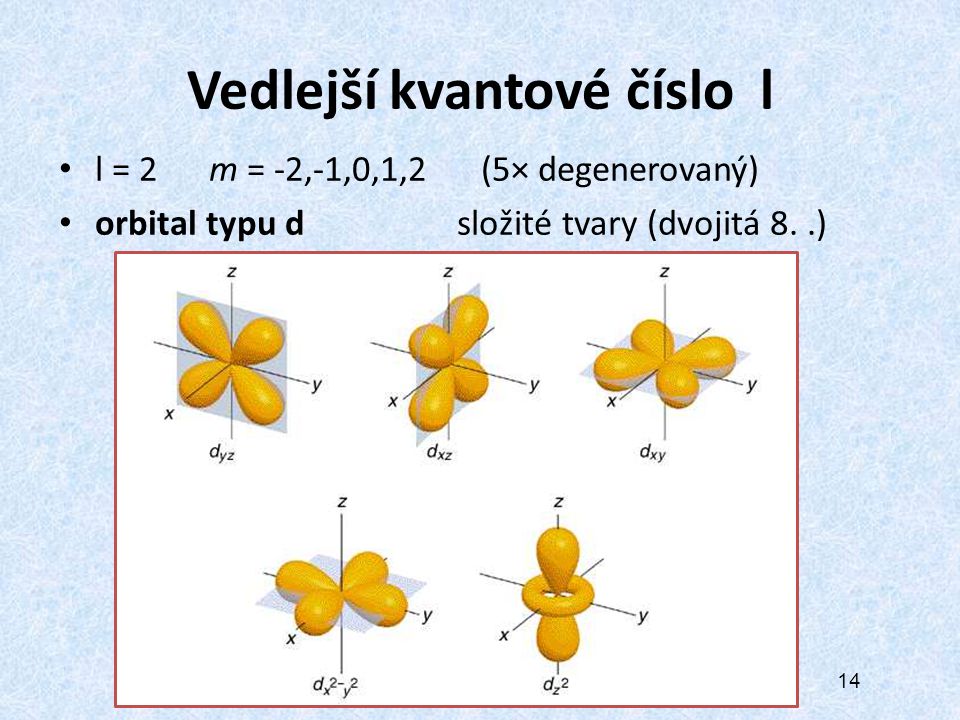
Pokud umísťujeme elektrony do degenerovaných orbitalů, zaplníme nejprve každý takový orbital jedním elektronem a teprve potom jej párujeme s druhým elektronem s opačným spinem.
Jak vzniká excitovaný atom
Pokud atom přijme určité množství energie, pak může být elektron přenesen z orbitalu s nižší energií do volného orbitalu s vyšší energií – pak mluvíme o excitovaném stavu atomu.
Pro každý orbital zapíšeme hlavní kvantové číslo, shodné s číslem periody, a poté písmenem zapíšeme vedlejší kvantové číslo. Nakonec do pravého horního indexu (na místo mocniny) napíšeme, kolik se v daném orbitalu vyskytuje elektronů. Například tak můžeme dostat zápis 2p5 2 p 5 .Atom může mít 1 – 7 elektronových vrstev. Počet elektronů v jednotlivých vrstvách atomu je přesně stanoven. Rozmístění elektronů v elektronovém obalu (elektronová konfigurace atomu) určuje chemické vlastnosti prvků.
Co je menší jak atom : Atom je základní stavební částice, ze které se skládá všechno kolem nás. Samotný atom dále tvoří 3 menší částice: PROTON, NEUTRON a ELEKTRON v různém počtu. Proton s neutronem tvoří jádro atomu.