Antwort Jak se dělí roztoky? Weitere Antworten – Jak Delime roztoky
roztok pevné látky a kapaliny (cukr rozpuštěný ve vodě, sůl rozpuštěná ve vodě) roztok dvou kapalin (ethanol rozpuštěný ve vodě – alkoholické nápoje) roztok plynu a kapaliny (oxid uhličitý ve vodě – šumivé nápoje) roztok nejméně dvou plynů (vzduch)Roztok je homogenní směs dvou nebo více látek (solutů). Roztoky mohou být plynné (např. vzduch), kapalné nebo pevné (slitiny kovů). V lidském organismu se vyskytují roztoky kapalné, v nichž rozpouštědlem je voda.5 % roztok NaCl znamená, že v 100 dílech (g, kg, t, …,) roztoku je 5 dílů NaCl a 95 dílů vody.
Jak jinak říkáme roztoku : Co je potřeba si zapamatovat. Směs/roztok s jednotným složením nazýváme homogenní směs/roztok neboli stejnorodá směs/roztok. Směs s nejednotným složením nazýváme heterogenní směs. Chemická látka, která tvoří většinu roztoku, se nazývá rozpouštědlo, ostatním složkám říkáme rozpuštěná látka.
Jak Delime roztoky podle skupenství
Roztok může existovat ve skupenství plynném, kapalném a pevném. V prvním případě jím rozumíme směs dvou nebo více plynů, jež spolu chemicky nereagují. Roztok ve skupenství pevném se nazývá tuhý roztok a rozumíme jím látky pevné fáze obsahující více než jednu složku.
Jak muzeme popsat roztok : Roztok můžeme popsat pomocí molarity, ta vyjadřuje počet molů rozpuštěné látky v litru roztoku. Nebo molality, což je počet molů rozpuštěné látky na kilogram rozpouštědla. Nebo pomocí hmotnostních procent. Hmotnostní zlomek vyjadřuje hmotnost rozpuštěné látky lomeno hmotnost celková.
Podle velikosti částic můžeme směsi dělit na homogenní (částice menší než 10−9 m), heterogenní (větší než 10−7 m) a koloidní (10−9 až 10−7 m). Směs může být rozdělena na jednotlivé složky mechanicky využitím různých fyzikálně-chemických postupů.
Směsi rozdělujeme podle velikosti částeček jednotlivých složek. Dělíme je na směsi stejnorodé, které nazýváme roztoky, směsi koloidní a různorodé. Roztok je homogenní směs jedné nebo více látek rozpuštěná v jiné látce (rozpouštědle).
Co je 10% roztok
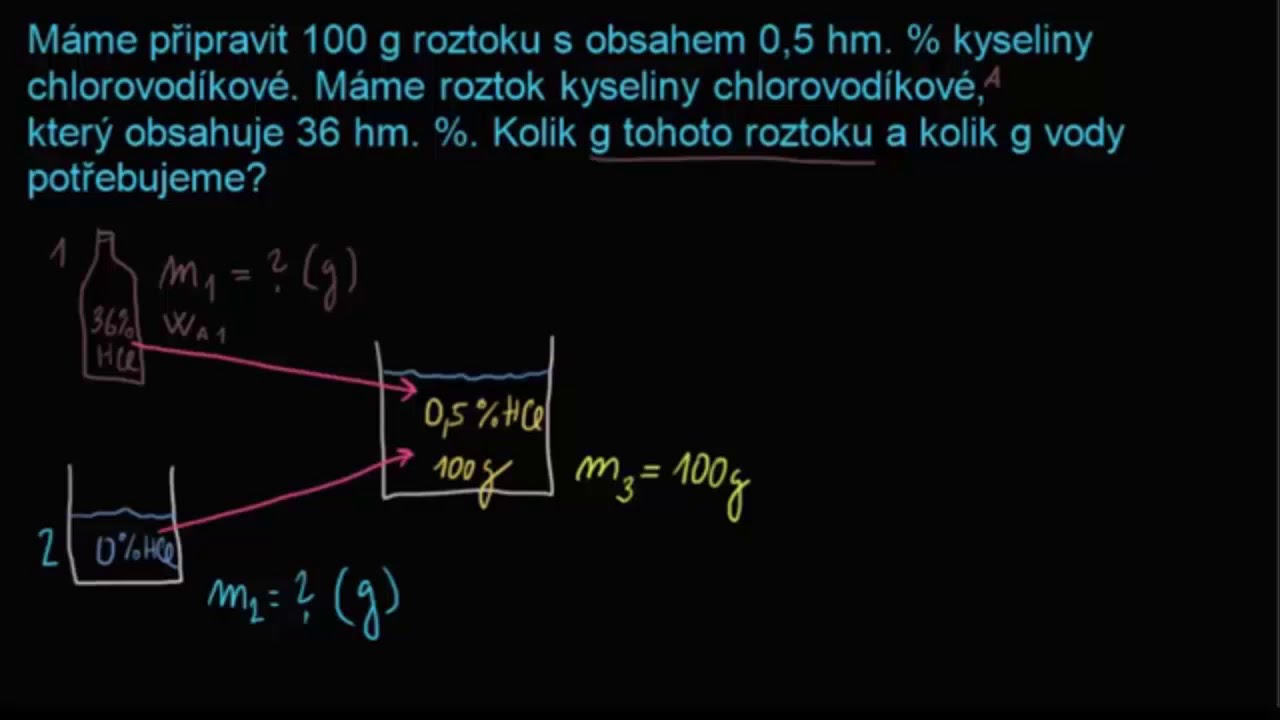
100/80 = 31,25% Page 5 3) 10% roztok obsahuje 10 g rozpuštěné látky a 90 g rozpouštědla.Příklad: Máme připravit 1 % (w/v) NaCl. Použijeme tedy 1 g NaCl, který rozpustíme v daném roztokku (případně ve vodě) a doplníme do výsledného objemu 100 ml. Výpočet molární koncentrace z procentuální koncentrace: Při tomto výpočtu je třeba znát údaj o molární hmotnosti dané látky (MW) a její hustotě.Hmotnost roztoku se značí m ⊙ , a vypočítá se jako součet hmotnosti rozpuštěné látky A (např. NaCl – chlorid sodný, kuchyňská sůl) a hmotnosti rozpouštědla (rozpouštědlo může být např. voda). Hmotnostní zlomek je bezrozměrná veličina (je bez jednotky), a nabývá hodnot od 0 do 1.
Nasycený roztok je takový roztok, ve kterém se další množství rozpuštěné látky již nerozpouští. Nenasycený roztok je takový roztok, ve kterém je rozpuštěné látky méně, než odpovídá rovnovážnému nasycení roztoku.
Kdy je roztok kyselý : Kyselé roztoky mají hodnotu pH nižší než 7, zásadité roztoky mají hodnotu pH vyšší než 7.
Co je to směs příklady : Směs se skládá z více chemických látek. Při jejich mísení nedochází ke změnám vazeb. Mohou se však měnit fyzikální vlastnosti: např. voda se solí má nižší teplotu tání než čistá voda.
Jak dělíme stejnorodé směsi
V závislosti na vnějších podmínkách mohou být homogenní směsi:
- plynné (například vzduch, propanbutanová směs)
- kapalné (například roztok kuchyňské soli ve vodě, ocet, čaj)
- pevné (například slitina bronz, sklo).
Příklad: Příprava 20 % (w/w) NaCl. 20 g NaCl je rozpuštěno ve 100 g výsledného roztoku. Objemová procenta (v/v) jsou definována jako počet mililitrů látky na 100 ml výsledného roztoku.c = n/V. Obvykle se látková koncentrace vyjadřuje v jednotkách mol/l (mol dm–3) a můžeme se setkat se starším značením 1 mol/l = 1 M. Vypočítejte látkovou koncentraci NaCl ve 200 ml roztoku, na jehož přípravu jsme použili 10 g NaCl (M = 58,44 g/mol).
Jak se počítá ředění roztoku : Systém počítá pouze veličiny vztažené k objemu (hmotnostní koncentrace, objemová koncentrace či molární koncentrace). Vzorce pro výpočet těchto veličin jsou vždy stejné: V = V1 + V2, c = (c1*V1 + c2*V2) / V. V je zde objem a c koncentrace roztoku, veličiny s indexem se vztahují k 1., resp. 2.