Antwort Jaký tvar má Orbital p? Weitere Antworten – Jak jdou za sebou orbitaly
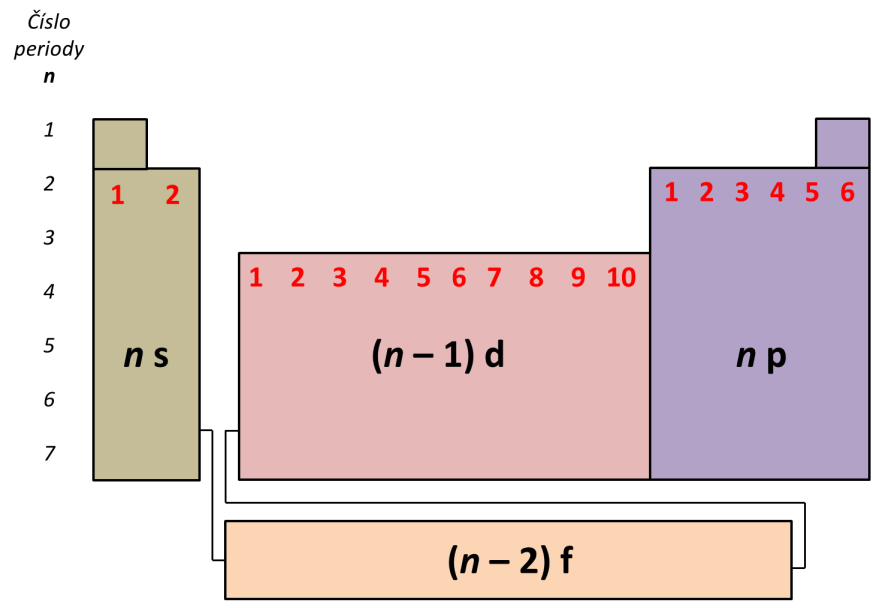
Orbitaly se obsazují podle rostoucí energie v pořadí: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, … S tímto pořadím zcela koresponduje uspořádání prvků v periodickém systému.Atomy prvků v třetí periodě, s hlavním kvantovým číslem 3, mají své elektrony v orbitalech 1s, 2s, 2p, 3s a 3p. Podle pravidla n + l po 3p následuje 4s, 3d a 4p. Ve čtvrté periodě elektrony draslíku a vápníku zaplňují orbital 4s, poté následuje 10 prvků (od skandia až po zinek), jejichž elektrony zaplňují orbitaly 3d.se značí n, vyjadřuje energii elektronu. Nabývá hodnot 1 až 7. Orbitaly, které mají stejné hlavní kvantové číslo, tvoří jednu elektronovou vrstvu. Atomy dosud známých prvků obsazují elektrony 7 elektronových vrstev, které se označují čísly 1 až 7 nebo písmeny K,L,M,N,O,P,Q.
Jak poznat hlavní kvantové číslo : HLAVNÍ KVANTOVÉ ČÍSLO
Nabývá hodnot n1, n2, n3 až n8 nebo také K, L, M až R, což do určité míry odpovídá číslu periody. Pokud tak budou objeveny další prvky, může nám přibýt i n9 nebo vyšší. Na hlavním kvantovém číslu závisí energie elektronů a velikost orbitalu.
Co je to orbital
Orbital je trojrozměrný útvar (část prostoru). Záporně nabité částice elektronu, které jsou v obalu atomu, se rychle pohybují. Používá se zjednodušený model záporného náboje pro orbitaly. Oblast výskytu elektronu (orbital) není ostře ohraničena.
Co je to Vakantní orbital : Existencí tzv. vakantních orbitalů (→ orbitalů, jenž neobsahují elektrony, mají však stejné n jako zaplňené orbitaly) a dodáním energie lze vaznost zvětšit tím, že elektron vystoupí na vyšší energetickou hladinu (! stejné n, vyšší l). To dovoluje atomu poskytnout více nepárových elektronů a tím i větší vaznost.
Orbital atomový
vymezují jakousi existenční oblast elektronu v atomu. Této oblasti nejpravděpodobnějšího výskytu elektronu se říká atomový orbital. Atomové orbitaly se označují symbolem obsahujícím hlavní kvantové číslo n a písmeno, které odpovídá hodnotě vedlejšího kvantového čísla l.
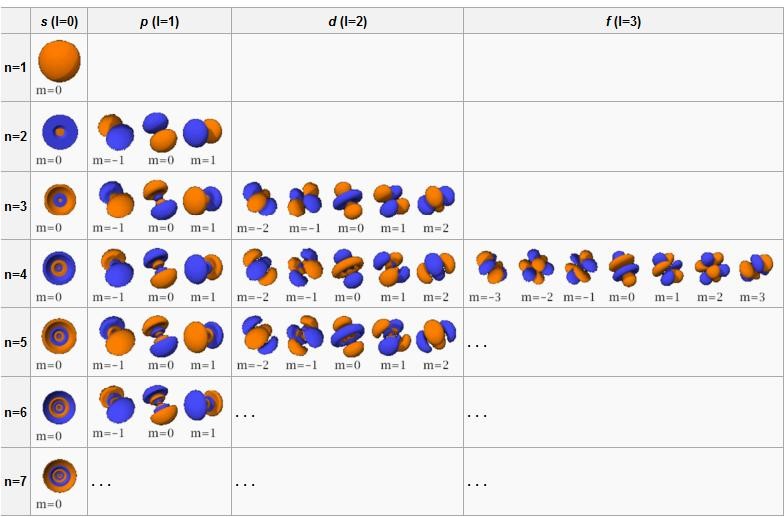
Vedlejší kvantové číslo (označováno písmenem l) je závislé na hlavním kvantovém čísle (n) a jeho maximální hodnotu lze vypočítat jako l=n-1. Charakterizuje orbitální moment hybnosti elektronu a tvar (prostorovou náročnost) orbitalu.
Jak se počítá kvantové číslo
Hlavní kvantové číslo ( n) je přirozené číslo. Souvisí s energií elektronů a velikostí orbitalů (čím větší n, tím se elektrony mohou nacházet dále od jádra). Vedlejší kvantové číslo ( l) udává typ orbitalu, spočítá se dle vztahu l = n − 1 l = n – 1 l=n−1.Orbital Sciences Corporation
| Orbital Sciences | |
|---|---|
| Základní údaje | |
| Nástupce | Orbital ATK |
| Zakladatelé | David Thompson, Bruce Ferguson a Scott Webster |
| Sídlo | Dulles, Virginie, USA |
Orbital p (l = 1) má tvar dvou rotačně symetrických laloků, vzájemně středově symetricky vybíhajících od středu atomu do směru vybrané souřadné osy (v každém laloku má vlnová funkce jiné znaménko). Magnetické číslo může nabývat hodnot m = −1,0,1, orbital je tedy 3× degenerovaný.
Excitace (neboli vybuzení) je fyzikální proces, při kterém dochází k přechodu základního energetického stavu atomu, molekuly či iontu do stavu s vyšší energetickou hladinou. Excitovaná částice se pak nachází v excitovaném stavu.
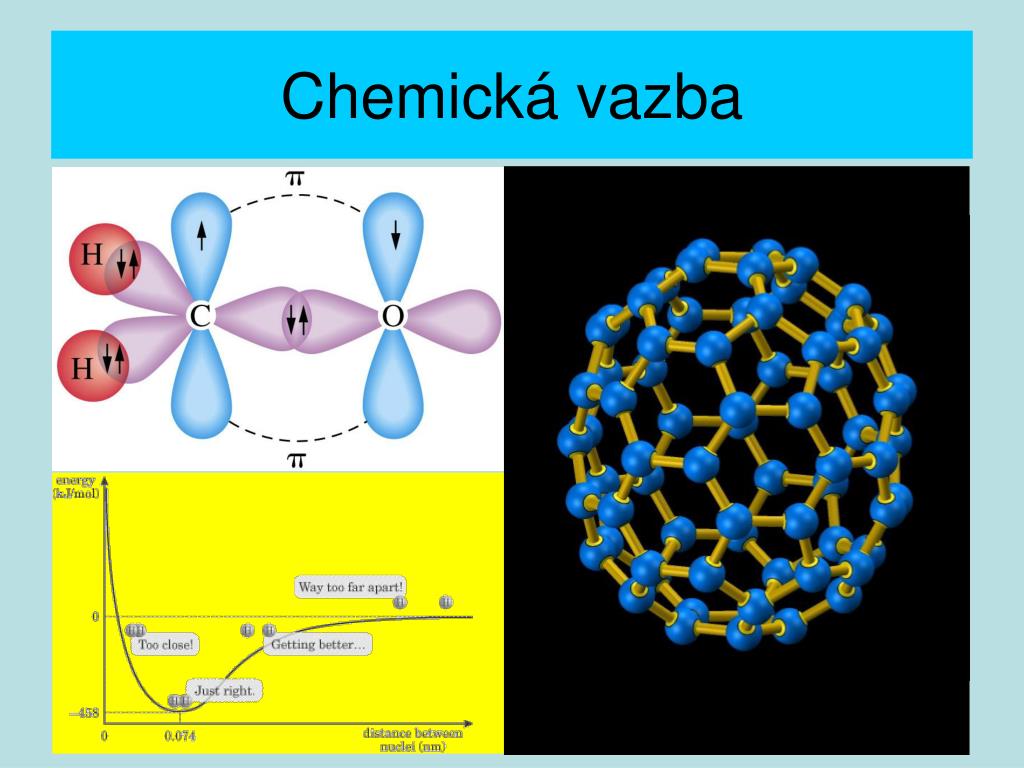
Co spojuje atomy : Chemická vazba je silová interakce poutající navzájem sloučené atomy, která je energeticky stabilizuje a vede ke vzniku molekuly. Vzniklá molekula má potom nižší energii, než měly původní atomy před sloučením. Základ všech vazeb spočívá ve společném sdílení nebo předávání vazebných elektronů příslušnými částicemi.
Jaká jsou kvantová čísla : Kvantová čísla jsou čísla, kterými se v kvantové mechanice popisují vlastnosti určitých částic v systému; každé číslo odpovídá jedné zachovávané veličině. Nejčastějším použitím kvantových čísel je popis elektronů a jejich orbitalů v atomovém obalu, například v chemii.
Kolik je modelů atomu
Tento článek je však zaměřen hlavně na pět modelů atomu, které přispěly k dnešnímu pojetí jeho struktury – Daltonův model, Thomsonův „pudinkový“ model, Rutherfordův planetární model, Bohrův model a kvantově mechanický model/model elektronového mraku.
Lze si je představit jako malá tělíska, která jsou tak malá, že je nemůžeme pozorovat vlastníma očima A tato tělíska, již nemůžeme více rozdělit. Někdy též atom nazýváme částicí, což je to samé jako malá část látky. Atom si znázorňujeme pomocí kuličkového modelu atomu.Hundovo pravidlo (Pravidlo maximálního spinu)
Pokud umísťujeme elektrony do degenerovaných orbitalů, zaplníme nejprve každý takový orbital jedním elektronem a teprve potom jej párujeme s druhým elektronem s opačným spinem.
Kdy dochazi k excitaci atomu : Příčiny excitace
Jestliže se volný elektron (řidčeji ion nebo neutrální atom) přiblíží do těsné blízkosti atomu, předá mu část své kinetické energie. Jestliže předaná energie odpovídá přesně rozdílu dvou energetických hladin, vázaný elektron přeskočí z nižší hladiny na vyšší.